REACCIONES QUÍMICAS
Es todo proceso termodinámico en el cual dos o más sustancias (llamadas reactantes o reactivos), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
A la representación simbólica de cada una de las reacciones se le denomina ecuación química.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.
CLASES DE REACCIONES QUÍMICAS
1- Reacciones de Síntesis o Adición
Es un proceso elemental en el que dos o más sustancias químicas reaccionan para generar un solo producto. Elementos o compuestos sencillos que se unen para formar un compuesto más complejo. La siguiente es la forma general que presentan este tipo de compuestos:
- A + B → C
Donde A y B representan cualquier sustancia química y C el compuesto resultante.
Algunas reacciones de síntesis se dan al combinar un óxido básico con agua, para formar un hidróxido, o al combinar el óxido de un no metal con agua para producir un oxi-ácido.
Ejemplos:
- Na2O(s) + H2O(l) → 2Na(OH)(ac)
- SO3(g) + H2O(l) → H2SO4(ac)
Otras reacciones de síntesis se dan al combinar un no metal con hidrógeno, para obtener un hidrácido.
Ejemplo:
- Cl2(g)+ H2(g) → 2HCl(g)
La oxidación de un metal, también es una reacción de síntesis o de combinación.
Ejemplo:
- 4Na(s) + O2(g) → 2Na2O(s
2- Reacciones de Análisis o Descomposición
En una reacción de descomposición, una sola sustancia se descompone o se rompe, produciendo dos o más sustancias distintas. A este tipo de reacciones se le puede considerar como el inverso de las reacciones de combinación. El material inicial debe ser un compuesto y los productos pueden ser elementos o compuestos. Generalmente se necesita calor para que ocurra la reacción. La forma general de estas ecuaciones es la siguiente:
En general, para algunos tipos de compuestos estas reacciones son más específicas. Consideremos unas pocas entre las más comunes.
Hidratos
Cuando se calientan los hidratos se descomponen para dar lugar a agua y sal anhidra.. Un hidrato es una sal que contiene una o más moléculas de agua por cada unidad fórmula y posee estructura de cristal. Cuando estas sustancias se calienta, se desprende agua; por ejemplo el sulfato de cobre pentahidratado se descompone de acuerdo a la siguiente ecuación:
Cloratos
Cuando se calientan los cloratos, se descomponen dando cloruros más oxígeno. Por ejemplo, el clorato de potasio se descompone de acuerdo a la siguiente ecuación:
Oxidos de metales
Algunos pocos se descomponen al calentarlos dando lugar al metal libre y oxígeno. Por ejemplo el óxido mercúrico se descompone de acuerdo a la siguiente ecuación:
Carbonatos
La mayoría de carbonatos se descomponen al calentarlos dando óxidos y CO2. Por ejemplo carbonato cálcico (piedra caliza) cuando se calienta forma óxido de calcio (cal viva) y CO2 de acuerdo a la siguiente ecuación:
3- Reacciones de Desplazamiento
En una reacción de desplazamiento, un átomo de un compuesto se reemplaza por un átomo de otro elemento:
-
-
-
-
-
-
-
-
-
-
- A + BC → AC + B
-
-
-
-
-
-
-
-
-
La mayoría de las reacciones de desplazamiento se agrupan en tres subcategorías:
- Desplazamiento de hidrógeno
- Desplazamiento de metal
- Desplazamiento de halógeno
Todos los metales alcalinos y algunos metales alcalino térreos (Ca, Sr y Ba), que son los más reactivos de los elementos metálicos, desplazarán al hidrógeno del agua fría:
-
-
-
-
-
- 2Na(s) + 2H2O(l) → 2NaOH(ac) + H2(g)
-
-
-
-
Los metales menos reactivos, como el aluminio y el hierro, reaccionan con vapor de agua para dar gas hidrógeno:
-
-
-
-
-
- 2Al(s) + 3H2O(g) → Al2O3(s) + 3H2(g)
-
-
-
-
Muchos metales, incluidos los que no reaccionan con el agua, pueden desplazar al hidrógeno de los ácidos. Por ejemplo el Zinc (Zn) y el magnesio (Mg) no reaccionan con el agua pero sí con el ácido clorhídrico:
-
-
-
-
-
- Zn(s) + 2HCl(ac) → ZnCl2(ac) + H2(g)
-
-
-
-
-
-
-
-
-
- Mg(s) + 2HCl(ac) → MgCl2(ac) + H2(g)
-
-
-
-
Estas reacciones se utilizan para preparar gas hidrógeno en el laboratorio.
Un metal de un compuesto también puede ser desplazado por otro metal en estado libre. Una forma sencilla de predecir si en realidad va a ocurrir una reacción de desplazamiento de un metal o de hidrógeno, es referirse a una serie de actividad.
De acuerdo con esta serie, cualquier metal que se ubique arriba del hidrógeno, lo desplazará del agua o de un ácido, pero los metales situados debajo del hidrógeno no reaccionarán ni con agua ni con ácidos.
Las reacciones de desplazamiento de metal tiene muchas aplicaciones en los procesos metalúrgicos, en los cuales interesa separar los metales puros a partir de sus minerales.
El vanadio se obtiene por tratamiento de óxido de vanadio con calcio metálico.
El comportamiento de halógenos en reacciones de desplazamiento de los halógenos se puede resumir en otra serie de actividad:
-
-
-
-
-
-
-
-
- F2 >Cl2 >Br2 > I2 elementos como agentes oxidantes disminuye conforme se avanza del flúor al yodo en el grupo VllA, así el flúor molecular se puede desplazar.
-
-
-
-
-
-
-
4- Reacciones de Doble Sustitución
Son también muy simples, pero debemos quedar atentos a los detalles. El mecanismo es fácil:
AB + CD —– > AD + CB
Ciertamente ya habrá podido ver lo que sucede. A cambió de lugar con C. La diferencia de este tipo de reacción con el desplazamiento, es que ni A ni C estaban solos y en ambos casos ninguno de ellos quedó solo luego de la sustitución.
Para entender como es cuando una reacción de este tipo ocurre, tendremos que observar lo siguiente:
La substancia AB esta en solución y de esta forma lo que tenemos en verdad son los iones A+ y B- separados unos de los otros. La substancia CD también está en solución, por tanto tenemos también los iones C+ y D- separados.
Cuando juntamos las dos soluciones estamos promoviendo una gran mezcla entre los iones A+, B-, C+ y D-, formando una gran “sopa de iones”.
Si al combinar C+ con B-, el compuesto CB fuera soluble, los iones serán nuevamente separados en C+ y B-, resultando exactamente en la misma cosa que teníamos anteriormente. Lo mismo sucede con A+ y B-
Así, al mezclar AB con CD, estamos en verdad haciendo:
(A+ ) + (B- ) + (C+ ) + (D- )
Tomemos en cuenta que juntar iones que se separarán nuevamente resultará en la misma “sopa de iones” y no resulta en ninguna nueva susbtancia, por tanto no ocurre ninguna reacción.
Para que la reacción efectivamente ocurra, será necesario que al menos uno de los probables productos (AD o CB) no sean separados al juntarse, o sea, deben formar un compuesto insoluble y esto es logrado a través de una sal insoluble, de un gas o de agua.
Si uno de los productos fuera una sal insoluble el no será separado en iones y permanecerá sólido. Si fuese un gas, el se desprenderá de la solución (burbujas) y también permanecerá con sus moléculas agrupadas. Mientras que si uno de los productos fuese agua, ella no se desagrega en su propia presencia.
- NaCl + AgNO3 —– > NaNO3 + AgCl
En esta reacción el producto AgCl (cloruro de prata) es insoluble, por tanto la reacción ocurre.
- NaCl + LiNO3 —– > NaNO3 + LiCl
Como ninguno de los productos formados, NaNO3 (nitrato de sodio) o Li. (Cloruro de Litio) es insoluble, la reacción no sucede.
- NaOH + HCl —– > NaCl + H2O
Como uno de los productos es água (H2O), la reacción ocurre.

ECUACIONES QUÍMICAS
Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (llamadas reactivos ) y las sustancias que se originan (llamadas productos). La ecuación química ayuda a visualizar los reactivos que son los que tendrán una reacción química y los productos, que son las sustancias que se obtienen de este proceso. Además se pueden ubicar los símbolos químicos de cada uno de los elementos o compuestos que estén dentro de la ecuación y poder balancearlos con mayor facilidad.
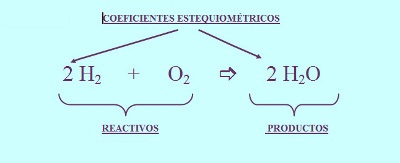
Por ejemplo el hidrógeno gas (H2) puede reaccionar con oxígeno gas(O2) para dar agua (H20). La ecuación química para esta reacción se escribe:
El "+" se lee como "reacciona con"
La flecha significa "produce".
Las fórmulas químicas a la izquierda de la flecha representan las sustancias de partida denominadas reactivos.
A la derecha de la flecha están las formulas químicas de las sustancias producidas denominadas productos.
Los números al lado de las formulas son los coeficientes (el coeficiente 1 se omite).
COMO ESCRIBIR ECUACIONES QUÍMICAS
Una ecuación química usa los símbolos y fórmulas de los reactivos y productos, y otros términos simbólicos para representar una reacción química. Las ecuaciones se escriben siguiendo los siguientes pasos:
- Los reactivos se separan de los productos con una flecha (
) que indica el sentido de la reacción. Una flecha doble (
) indica que la reacción se efectúa en ambas direcciones y establece un equilibrio entre los reactivos y los productos.
- Los reactivos se colocan a la izquierda y los productos a la derecha de la flecha. Un signo (+) se coloca entre cada reactivo y entre cada producto, cuando es necesario.
- Las condiciones necesarias para efectuar la reacción pueden, si se desea, colocarse arriba o abajo de la flecha o signo de igualdad. Por ejemplo, una letra delta mayúscula (
) colocada sobre la flecha (
) indica que se suministra calor a la reacción.
- Se colocan coeficientes (números enteros) frente a los símbolos de las sustancias (por ejemplo, 2 H2O) para equilibrar o balancear la ecuación e indicar el número de unidades fórmula (átomos, moléculas, moles, iones) de cada sustancia que reacciona o que se produce. Cuando no se indica número alguno, se sobrentiende que se trata de una unidad fórmula.
- El estado físico de la sustancias se indica mediante los siguientes símbolos: (s) para el estado sólido; (l) para el estado líquido; (g) para el estado gaseoso; y (ac) para las sustancias en solución acuosa.
- Empiece con las partes más complejas, es decir con los compuestos que tienen varios elementos. En algunos casos, simplemente consiste en ajustar primero los átomos diferentes al hidrógeno y al oxígeno.
- Ajuste el hidrógeno y el oxígeno agregando agua si es necesario, después de que todos los otros elementos estén balanceados.
- Deje los elementos en estado libre hasta el último momento, ya que cambiando los coeficientes de estos sólo cambian esta clase de átomos. Por ejemplo, cuando se escribe un 2 delante del H2O, se duplica el número de átomos de hidrógeno y oxígeno, pero cuando se escribe un 2 delante del Al sólo cambia el número de átomos de Al.
- Para reacciones con iones poliatómicos, ajuste el ion como grupo. Por ejemplo, el SO4-2 se ajusta como ion sulfato y no como átomos de S y átomos de O.
- Generalmente, si aparecen fracciones en la ecuación, se multiplica todo por el número más pequeño que elimine esta fracción. No es esencial hacer desaparecer las fracciones, sin embargo, es más simple en la mayoría de los casos. Además asegúrese al final, que todos los coeficientes estén en relación o proporción más baja posible; si no es el caso, simplifique.
ejemplo:
Empezando por el fosfato de magnesio (la parte más compleja) y considerando el fosfato de magnesio como grupo, escribimos un 2 delante del H3PO4 para ajustar el grupo fosfato y un 3 delante de Mg(OH)2 para ajustar el Mg dando como resultado:
Únicamente nos queda el hidrógeno y el oxígeno. Observando el hidrógeno, hay 12 átomos en la izquierda y por tanto necesitamos escribir un 6 delante del H2O. De igual forma se ajustan también los átomos de O que son en total 14. Esto da finalmente:
CONCLUSIÓN
las reacciones químicas son Es todo proceso termodinámico en el cual dos o más sustancias (llamadas reactantes o reactivos), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. y las ecuaciones químicas son es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (llamadas reactivos ) y las sustancias que se originan (llamadas productos) ambas son muy importantes y se necesitan entre si.
WEBGRAFIA
- https://www.google.com.co/search?q=reacciones+quimicas&oq=reacciones+quimicas+&aqs=chrome..69i57j0l5.3429j0j7&sourceid=chrome&ie=UTF-8
- https://www.google.com.co/search?q=reacciones+quimicas&source=lnms&tbm=isch&sa=X&ved=0ahUKEwjy4rTIxb3aAhUsrlkKHf2PCioQ_AUICigB&biw=1422&bih=1020#imgrc=zUWEHut6PSqeCM:
- https://www.google.com.co/search?q=reacciones+quimicas&source=lnms&sa=X&ved=0ahUKEwiR0NbNxb3aAhXpxlkKHbQwCf0Q_AUICSgA&biw=1422&bih=1020&dpr=0.9
- https://www.google.com.co/search?biw=1422&bih=1020&ei=4-_TWp6DK4eJ5wLg5ZDQDg&q=reacciones+sintesis+o+adicion&oq=REACCIONES+SINTE&gs_l=psy-ab.1.4.0l4j0i22i30k1l6.797.3218.0.7128.16.15.0.0.0.0.266.2053.0j11j1.12.0....0...1c.1.64.psy-ab..4.12.2047...35i39k1j0i67k1j0i131k1j0i131i67k1j0i20i263k1j0i10k1.0.OblnWiHUK-M
- https://www.google.com.co/search?q=reacciones+sintesis+o+adicion&source=lnms&tbm=isch&sa=X&ved=0ahUKEwj527G9xr3aAhVFx1kKHW7LDN8Q_AUICigB&biw=1422&bih=1020
- https://www.google.com.co/search?biw=1422&bih=1020&tbm=isch&sa=1&ei=3fDTWrG9M62G5wK4sJiYDA&q=reacciones+sintesis+&oq=reacciones+sintesis+&gs_l=psy-ab.3..0j0i30k1j0i8i30k1l6j0i24k1l2.19902.19902.0.20139.1.1.0.0.0.0.143.143.0j1.1.0....0...1c.1.64.psy-ab..0.1.143....0.k5iDFoAHeIo#imgrc=v-NpbErZGM6FmM:
- https://www.google.com.co/search?q=reacciones+sintesis&source=lnms&sa=X&ved=0ahUKEwj5w-66x73aAhVktlkKHSJaDWcQ_AUICSgA&biw=1422&bih=1020&dpr=0.9
- https://www.google.com.co/search?biw=1422&bih=1020&ei=OfHTWrKNEuqH5wLZvpG4BA&q=reacciones+de+analisis+o+descomposicion&oq=reacciones+ANALISIS+O+&gs_l=psy-ab.1.0.0i22i30k1l6.1236.4303.0.5873.11.11.0.0.0.0.415.1621.0j9j4-1.10.0....0...1c.1.64.psy-ab..1.10.1614...0.0.93xvp33_BnE
- https://www.google.com.co/search?q=reacciones+de+analisis+o+descomposicion&source=lnms&sa=X&ved=0ahUKEwjw_uqKyL3aAhUIm1kKHaojD-cQ_AUICSgA&biw=1422&bih=1020&dpr=0.9
AUTOR: KAROLL LIZETH PAZ HERNANDEZ



FALTO SEGUN INTERCAMBIO DE CALO 4.2
ResponderEliminarMe parece que está muy completa y muy clara la información sobre el tema, gracias.
ResponderEliminar